Текст слайда: 1)Углеводороды с общей формулой СnН2n+2 2) Частица с одним свободным электроном 3) Суффикс, который используется в названиях органических веществ для указания наличия в их молекуле двойной связи 4) Реакция взаимодействия органических веществ с азотной кислотой А лканы Р адикал Е н Нитрование Ы
Текст слайда: Задание Найти молекулярную формулу бензола, если массовая доля углерода в нем составляет 92,3%, а относительная плотность паров этого углеводорода по водороду составляет 39. Ответ: С6Н6
Текст слайда: Дано: W(с)=92,3% D(н2)=39 ____________ Формула-? А- СхНy Пусть А = 100 г m (c)=92,3 г ; m(н)= 7,7 г n= m:М; М (с) = 12 г/моль; М (н)= 1 г/моль; n(c )= 92,3 :12= 7,7 ( моль) n(н )= 7,7 : 1 = 7,7 (моль) Х : Y = 7,7 : 7,7 = 1:1 Эмпирическая формула СН Молекулярная формула (СН)z z= М (А) : М ( СН) М (СН) = 12 + 1= 13 ( г/моль) D( Н2) = М (А) : М(Н2) М(А)= D(H2) x M(Н2) М(А) = 39 х 2 =78 (г/ моль); z= 78 г/моль : 13 г/ моль = 6 Значит , молекулярная формула бензола (СН)6 или С6Н6
Текст слайда: Представитель — С6Н6 бензол Общая формула — СnН2n-6 «Свойства веществ зависят от химического строения их молекул» Какое химическое строение имеет бензол?
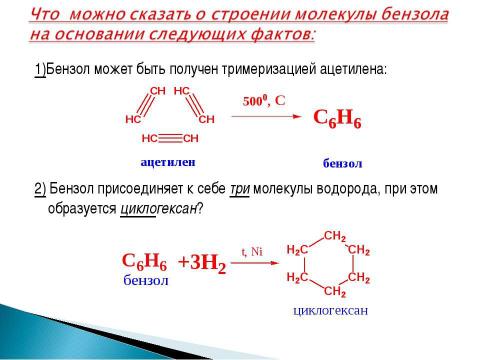
Текст слайда: 1)Бензол может быть получен тримеризацией ацетилена: 2) Бензол присоединяет к себе три молекулы водорода, при этом образуется циклогексан?
Текст слайда: Фридрих Август Кекуле фон Штрадониц (1829-1896) — немецкий химик-органик, создатель теории валентности.
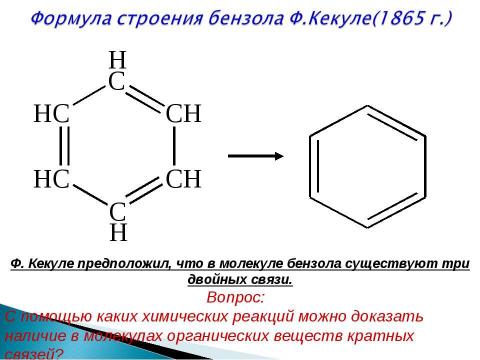
Текст слайда: Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи. Вопрос: С помощью каких химических реакций можно доказать наличие в молекулах органических веществ кратных связей?
Текст слайда: Вещество Тип Валентный Длина Форма гибридизации угол связи С-С молекулы Гексан SP3 109°28' 0,154 нм тетраэдр Гексен sр2 120° 0,134 нм плоская Гексин sр 180° 0,120 нм линейная Бензол sр2 120° 0,140 нм плоская
Текст слайда: 1)Тип гибридизации — sр2 2) между атомами углерода и углерода и водорода образуются сигма – связи, лежащие в одной плоскости. 3) валентный угол – 120 градусов 4) длина связи С-С 0,140нм
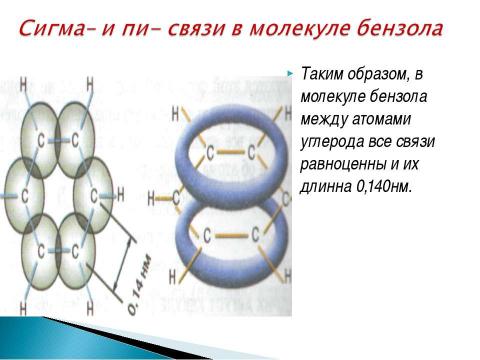
Текст слайда: 1)За счет негибридных р – электронных облаков в молекуле бензола перпендикулярно плоскости образования сигма — связей образуется единая п- электронная система, состоящая из 6 р – электронов и общая для всех атомов углерода.
Текст слайда: Таким образом, в молекуле бензола между атомами углерода все связи равноценны и их длинна 0,140нм.
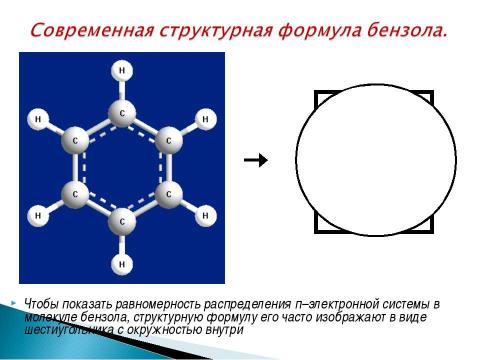
Текст слайда: Чтобы показать равномерность распределения п–электронной системы в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри
Текст слайда: Сочетание шести сигма – связей с единой п – системой называется ароматической связью Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядром.
Текст слайда: Давайте вспомним: 1)Характерный тип реакций для алканов 2) Характерный тип реакций для алкенов 3) Характерный тип реакций для алкинов Какой тип реакций будет характерен для бензола? 1) замещение 2) присоединение 3) присоединение
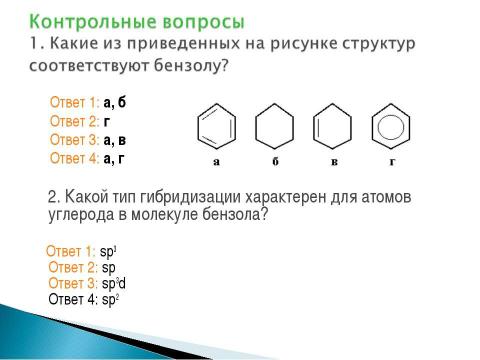
Текст слайда: Ответ 1: а, б Ответ 2: г Ответ 3: а, в Ответ 4: а, г 2. Какой тип гибридизации характерен для атомов углерода в молекуле бензола? Ответ 1: sp3 Ответ 2: sp Ответ 3: sp3d Ответ 4: sp2
Текст слайда: 1)Какова общая формула гомологического ряда аренов? 2) Какова молекулярная формула бензола? 3) Какое противоречие существует между структурной формулой Кекуле и свойствами бензола? Как это противоречие объясняет электронная теория? 4) Структурную формулу бензола представляют в виде шестиугольника с окружностью внутри. Что обозначает окружность? 5) Каковы физические свойства бензола?
Текст слайда: ОБЯЗАТЕЛЬНО: 1) Проанализировать конспект урока 2) Учебник, параграф 15, стр.96-99 Задание 6-1 стр.41 (задачник) По желанию: Творческое задание: подготовить презентацию по теме: «Применение бензола и его гомологов». Спасибо за урок!