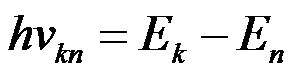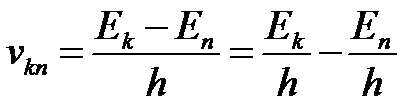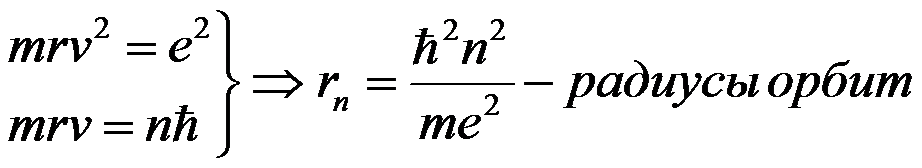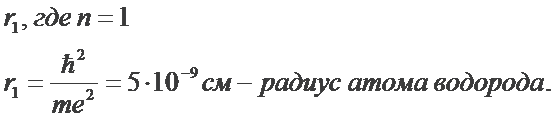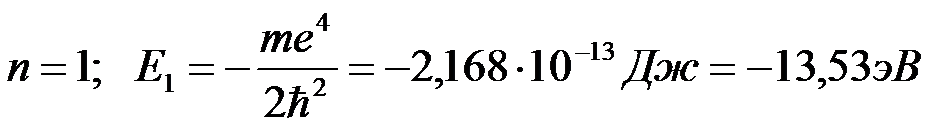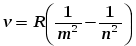


 Муниципальное общеобразовательное учреждение
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа№41»
г. Саратов
Конспект урока по физике
в 11 классе
Базовый уровень
«Постулаты Н. Бора»
Подготовила
учитель физики
Гусева Наталия Павловна
г. Саратов
2011 г.
Тема урока: Постулаты Н. Бора
Цель урока:
Изучить квантовые постулаты Бора. Модель атома водорода Бора. Показать значение теории Бора в развитии физической науки.
Задачи урока:
Образовательные задачи: изучить постулаты Бора, раскрывающие основные свойства атома, их значимость в развитии физической науки. Применять полученные знания при решении задач.
Развивающие задачи: развивать логическое мышление, правильную речь, естественнонаучное миропонимание о строении вещества.
Воспитательные задачи: воспитывать стремление учащихся демонстрировать собственные достижения, объективно оценивать свои умения применять знания.
Тип урока: изучение нового материала
Форма урока: комбинированный урок
Оборудование: компьютер, мультимедийный проектор, экран, презентация, тексты заданий, образовательный комплекс ФИЗИКА, 10–11 класс. ПОДГОТОВКА К ЕГЭ. (1С: Образование 3.0)
Ход урока:
1. Организационный момент(1-2 мин).
2.Проверка домашнего задания и актуализация изучаемой темы(6-8 мин).
А) ТЕСТ №1 (для учеников, сидящих за столами « на первом варианте»)
Выберите один правильный ответ из предложенных вариантов
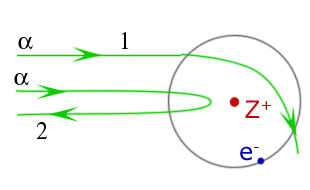
1. Принятая в настоящий момент в науке модель структуры атома обоснована опытами по…
-
растворению и плавлению твердых тел
-
ионизации газа
-
химическому получению новых веществ
-
рассеянию a-частиц
Ответ: d.
2.В опыте Резерфорда a-частицы рассеиваются…
-
электростатическим полем ядра атом
-
электронной оболочкой атомов мишени
-
гравитационным полем ядра атома
-
поверхностью мишени
Ответ: а.
3. Выберите один правильный ответ из предложенных вариантов
-
Только 1
-
Только 2
-
И 1, и 2
-
Ни 1, ни 2
Ответ: b
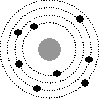
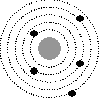
4.Какое утверждение соответствует планетарной модели атома?
| 1 |
| 2 |
| 3 |
| 4 |
Ответ: 3
6.Выберите один правильный ответ из предложенных вариантов.
| МAu » Мa >> Ме | |
|
| МAu > Мa >> Ме |
|
| МAu >> Мa >> Ме |
|
| МAu » Мa < Ме |
Ответ: МAu >> Мa >> Ме
В конце 2 этапа урока учениками проводится самоконтроль теста. Правильные ответы демонстрируются на экране в виде презентации учителя.
В) Фронтальный опрос
(опрашиваются ученики, сидящие за столами «на втором варианте»)
Домашние задание включало подготовку небольшой (4-5 слайдов) презентации к устному ответу на вопросы:
– Какова была цель опыта Резерфорда? Опишите установку Резерфорда, ход эксперимента.
Ответ ученика: экспериментально исследовать структуру атома.
Демонстрация фрагмента своей презентации.
–Какие результаты получил Резерфорд?
Ответ ученика: результаты эксперимента оказались неожиданными. Подавляющая часть альфа частиц проходила сквозь фольгу практически без отклонения или с отклонением на малые углы по отношению к направлению своего первоначального полёта. Но небольшая часть частиц отклонялась на значительные углы, достигающие почти 180°. Применив методы теории вероятностей, Резерфорд показал, что такие отклонения не могут быть следствием многократных столкновений альфа частиц с атомами, поэтому объяснить этот результат на основе модели атома Томсона невозможно. Демонстрация фрагмента своей презентации
— Какие выводы сделал Резерфорд из опыта?
Ответ ученика: демонстрация фрагмента своей презентации. Существует атомное ядро, в котором сконцентрирована почти вся масса атома и весь положительный заряд. Вокруг ядра по замкнутым орбитам вращаются отрицательные частицы электроны.
— Почему большинство ученых отрицательно отнеслись к модели атома Резерфорда?
Ответ ученика: Ядерная модель атома, предложенная Резерфордом, не могла объяснить факт существования атома, точнее — его устойчивость.
В соответствии с законами классической электродинамики Максвелла электроны при движении по орбитам c ускорением должны непрерывно излучать электромагнитные волны. Атом должен излучать свет и терять энергию. С потерей энергии электрон за время порядка 0.1 нс должен «упасть» на ядро, а атом прекратить своё существование. В действительности атомы излучают свет, но не исчезают при этом. Кроме того, частота вращения электрона по мере приближения к ядру будет изменяться плавно, т. е. спектр излучения атома должен быть непрерывным, а не линейчатым. Таким образом, по законам классической электродинамики атом Резерфорда должен быт неустойчивым, а его спектр излучения — непрерывным, что противоречило результатам экспериментов. Ученым пришлось признать ограниченность применения законов классической физики. Демонстрация фрагмента своей презентации.
Учитель:
Первым решился на это признание выдающийся физик XX в. датский ученый Нильс Бор. В 1913 г. он с помощью гениальной интуиции сформулировал в виде постулатов основные положения новой теории.
3.Изучение нового материала(12мин)
А. Постулаты Бора.
Изучая противоречия модели атома Резерфорда и законами классической физики, Нильс Бор выдвигает постулаты, определяющие строение атома и условия испускания и поглощения им электромагнитного излучения.
Постулаты Бора показали, что атомы подчиняются законам микромира.
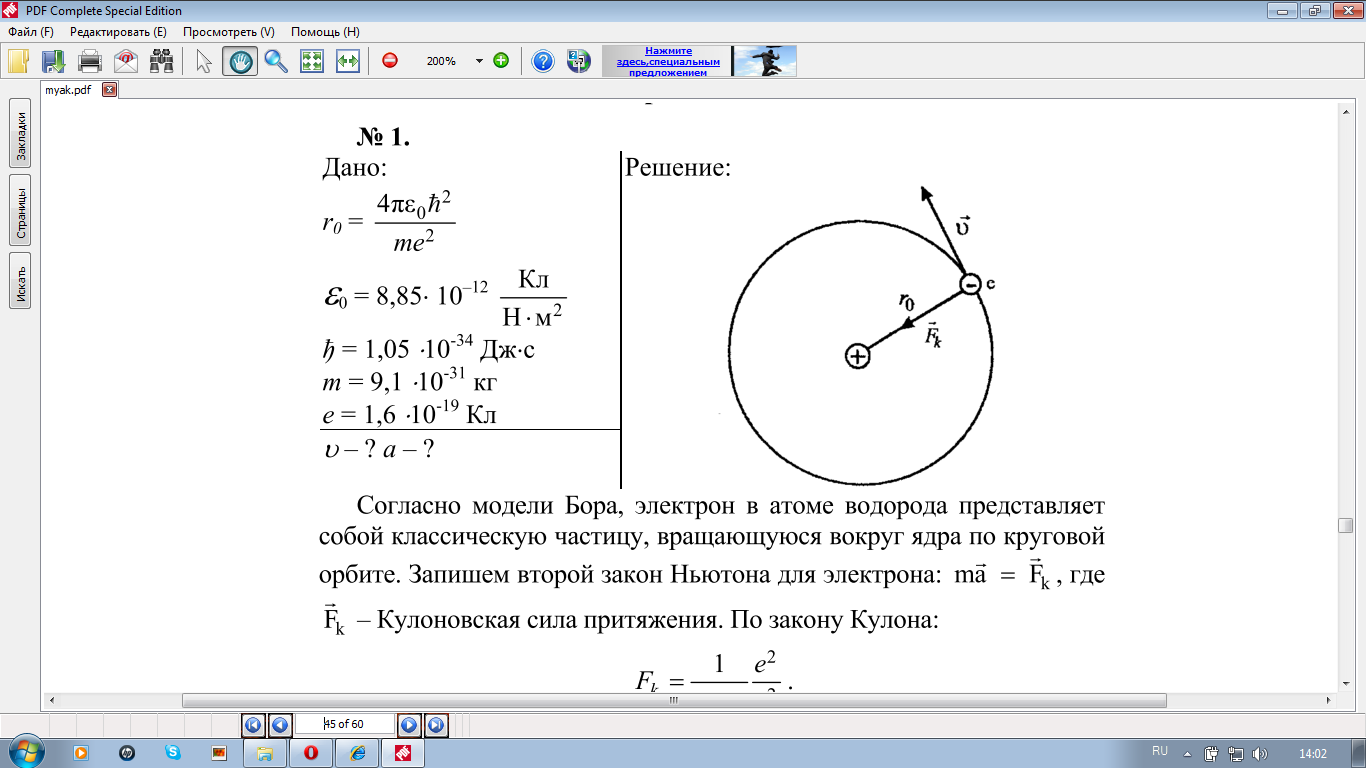
I постулат (постулат стационарных состояний).
Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает энергию, при этом электроны в атомах движутся с ускорением.
Атом может находиться в стационарном состоянии сколь угодно долго.
Стационарные состояния отличаются друг от друга различными орбитами, по которым движутся электроны в атоме. Набор электронных орбит, по сути, определяет стационарные состояния электрона в атоме. Стационарные состояния можно пронумеровать, присвоив им порядковый номер n=1, 2, 3, …,причем каждое состояние обладает своей фиксированной энергией Еn
II постулат (правило частот).
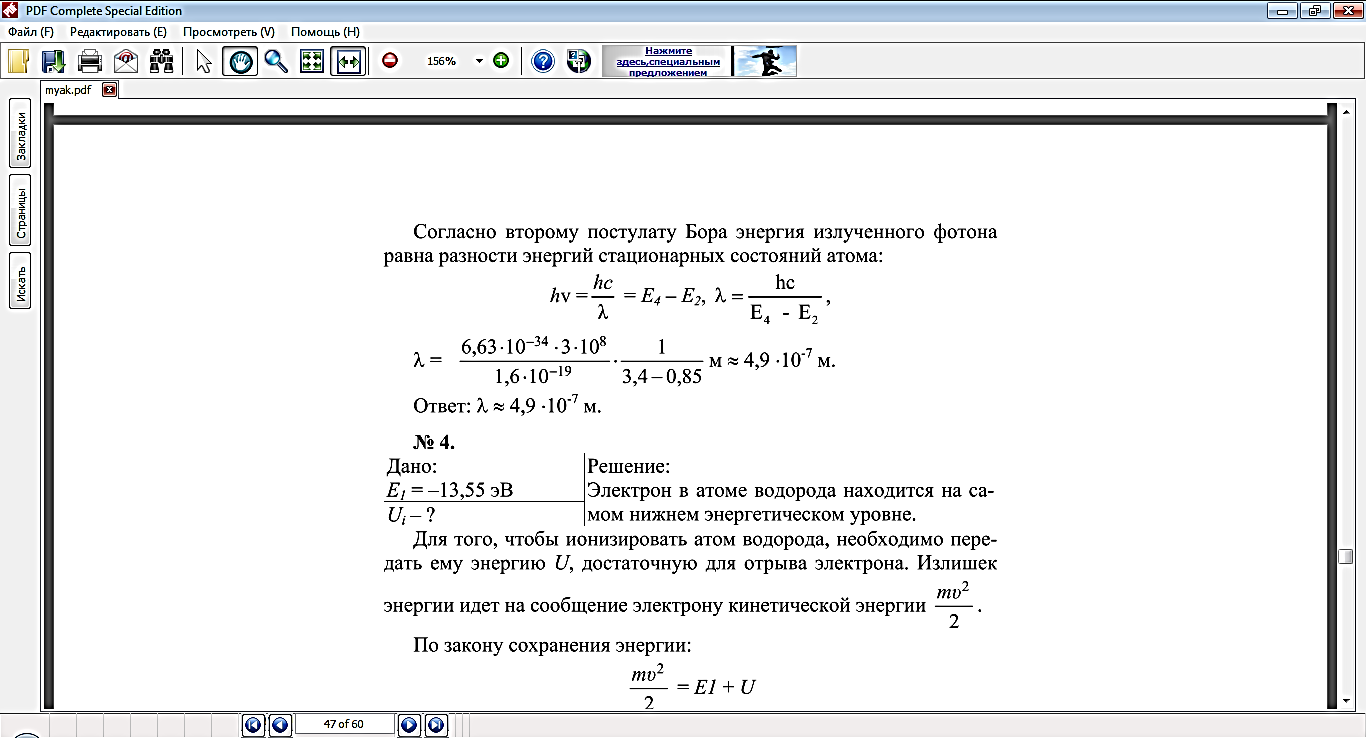
Излучение света происходит при переходе атома из стационарного состояния с большей энергией E k в стационарное состояние с меньшей энергией En. Энергия излучённого фотона равна разности энергий стационарных состояний:
Отсюда можно выразить частоту излучения:
При поглощении света, атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. При излучении атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией.
Демонстрация компьютерной модели излучения света атомом
Второй постулат противоречит электродинамике Максвелла, т.к. частота излученного света свидетельствует не об особенностях движения электрона, а лишь об изменении энергии атома.
В. Модель атома водорода по Бор
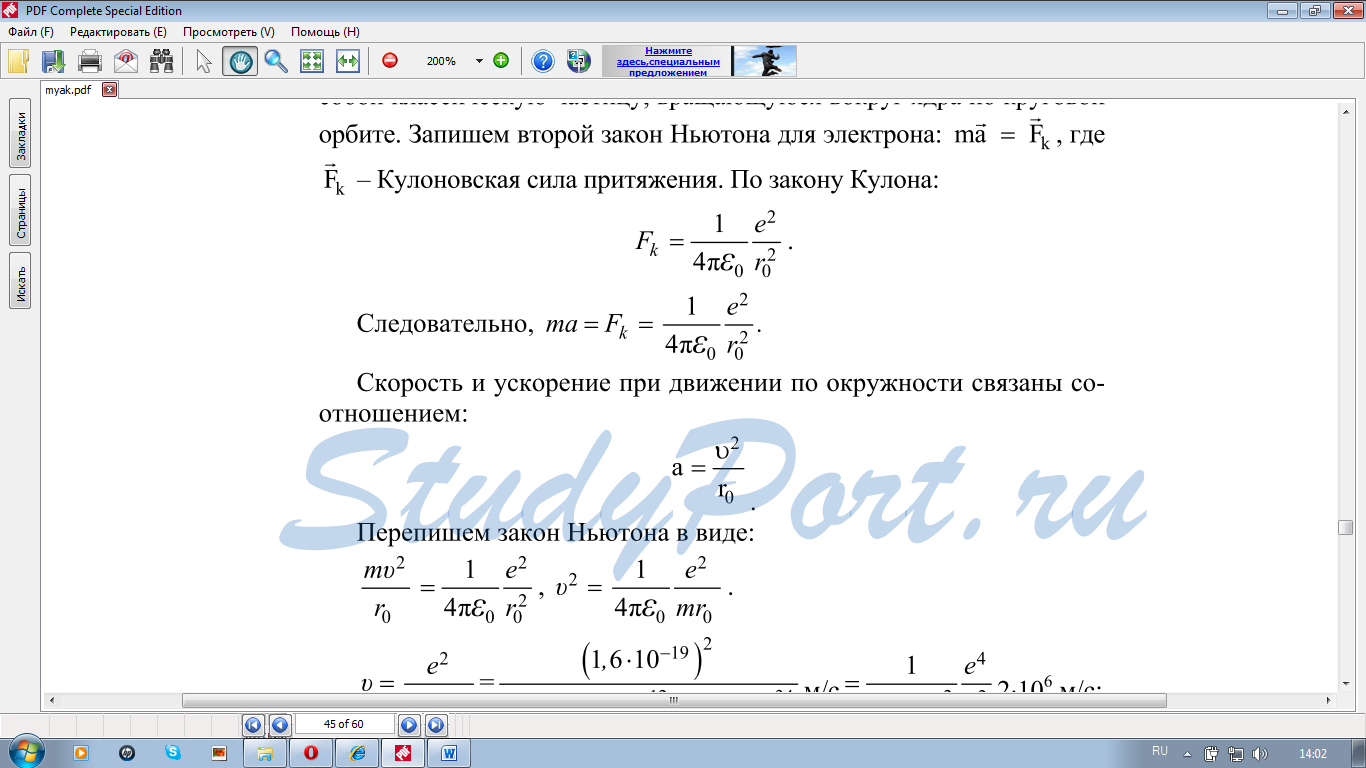
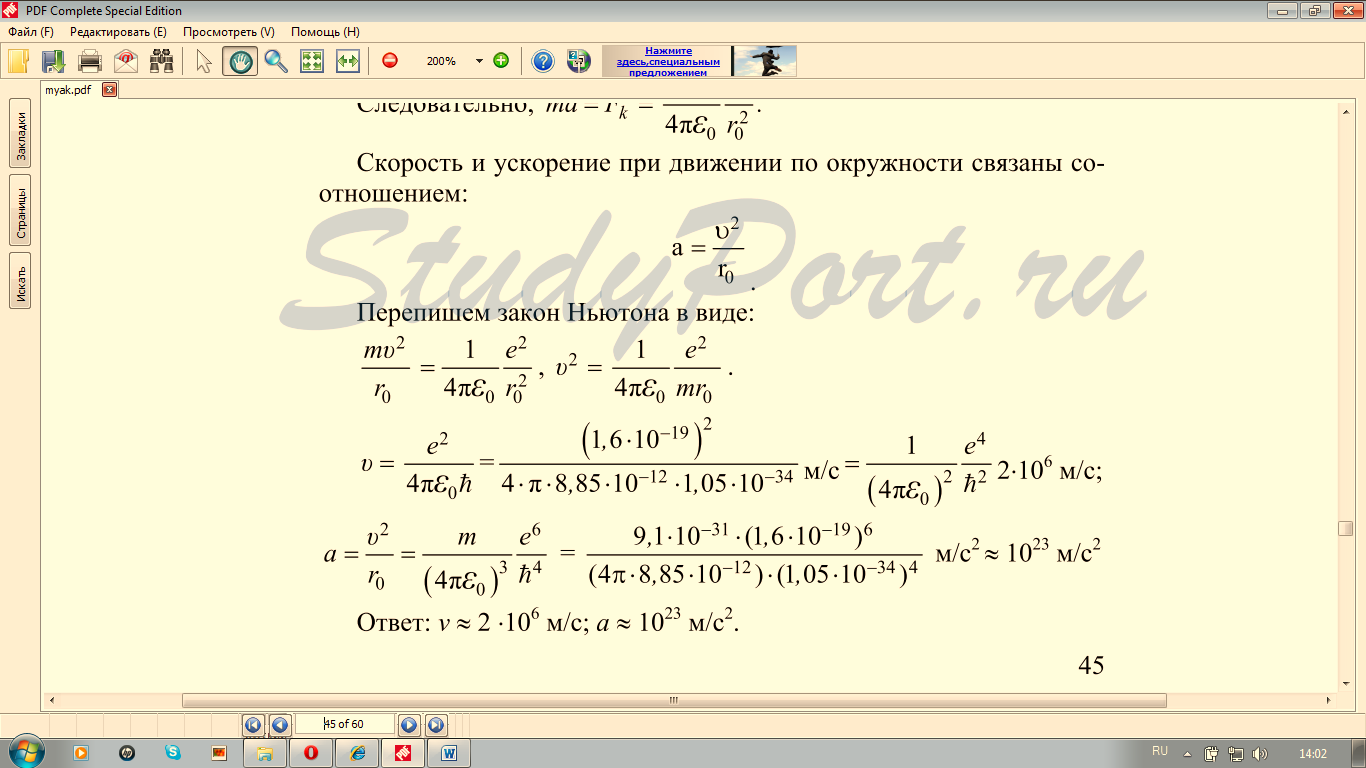
Используя законы механики Ньютона и правило квантования, на основе которого определяются возможные стационарные состояния атома. Бор смог вычислить радиусы орбит электрона и энергии стационарных состояний атома. Минимальный радиус орбиты определяет размеры атома.
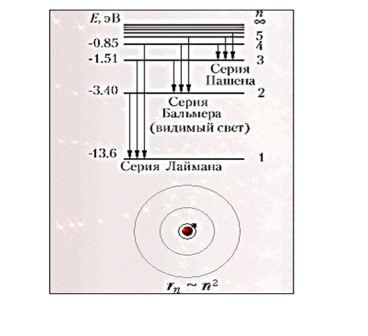
Для наглядного представления возможных энергетических состояний электрона в атоме используется энергетическая диаграмма (Демонстрация компьютерной модели излучения света атомом), на которой каждому энергетическому состоянию электрона в атоме Еn соответствует горизонтальная линия — энергетический уровень. Энергетическую диаграмму можно считать своеобразной «лестницей» с «нижней площадкой» (основным состоянием) и поднимающимися вверх «ступенями» (возбужденными состояниями). Значения энергий стационарных состояний отложены на вертикальной оси (в электрон — вольтах).
Обычно атом находится в основном состоянии (в этом состоянии атома электрон движется по первой стационарной орбите) с наименьшим значением энергии, равны:
Второй постулат Бора позволяет вычислить (по известным значениям энергий стационарных состояний) частоты излучений атома водорода.
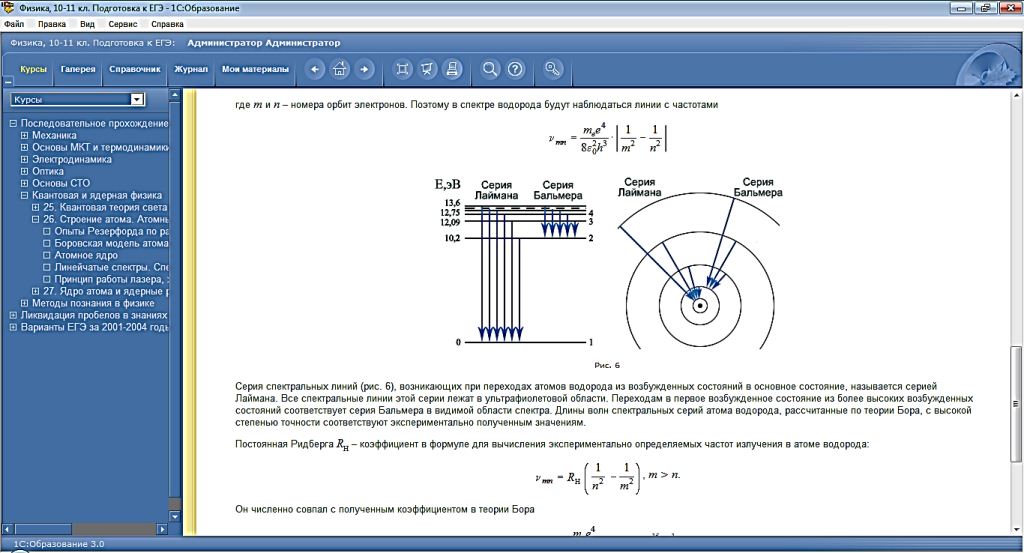
Теория Бора приводит к количественному согласию с экспериментом для значений этих частот. Все частоты излучений атома водорода составляют в своей совокупности ряд серий, каждая из которых образуется при переходах атома в одно из энергетических состояний со всех верхних энергетических состояний (состояний с большей энергией).
Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней образуют серию, названную по имени швейцарского учёного серией И. Бальмера. Эти переходы изображены стрелками: красная, зеленая и две синие линии в видимой части спектра водорода (рис. V, 3 на цветной вклейке в учебнике) соответствуют переходам: Е3 — Е2 , Е4 — Е2 , Е5 — Е2 , Е6 — Е2.).
Демонстрация диаграммы энергетических уровней атома водорода
И. Бальмер еще в 1885 г. на основе экспериментальных данных вывел простую формулу для определения частот видимой части спектра водорода.
R=109737, 31 (1/ см) – постоянная Ридберга.
Поглощение света — процесс, обратный излучению. Атом, поглощая свет, переходит из низших энергетических состояний в высшие состояния. При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие.
С. Значение постулатов Бора
Эйнштейн оценил проделанную работу Бором «как высшую музыкальность в области мысли», всегда его поражавшую.
На основе двух постулатов и правила квантования Бор определил радиус атома водорода и энергии стационарных состояний атома. Это позволило вычислить частоты излучаемых и поглощаемых атомом водорода электромагнитных волн. Теория Бора позволяет описать не только атом водорода, но и ионизированные атомы (ионы) других элементов, вокруг ядер которых, как и в атоме водорода, вращается один электрон. Такие ионы называются водородоподобными. Примерами водородоподобных ионов могут служить однократно ионизированный атом гелия (Не+), двукратно ионизированный атом лития (Li + +) и т. д.
Теория Бора явилась важным этапом в развитии квантовых представлений, введение которых в физику требовало кардинальной перестройки механики и электродинамики. Такая перестройка была осуществлена в 20-е – 30-е годы XX века, когда были созданы новые физические теории квантовая механика и квантовая электродинамика.
Однако надо помнить то, что для атомов с большим числом электронов (больше 1) расчеты по теории Бора неприменимы. Представление Бора об определенных орбитах, по которым движутся электроны в атоме, оказалось весьма условным. На самом деле движение электрона в атоме очень мало похоже на движение планет или спутников. Физический смысл имеет только вероятность нахождения электрона в том или ином месте окрестности ядра.
Демонстрация анимации модели атома по Шредингеру.
В настоящее время с помощью квантовой механики можно ответить практически на любой вопрос, относящийся к строению и свойствам электронных оболочек атомов. С количественным описанием электронных оболочек атомов вы познакомились в курсе химии.
Физические упражнения для профилактики утомляемости на уроке (3 мин)
4. Первичная проверка понимания учащимися нового материала (5мин)
1. Фронтальные вопросы:
1. Какие затруднения вызвала модель Резерфорда для объяснения
процессов излучения энергии атомами? Ядерная модель Резерфорда просто обосновывала экспериментальные данные, но не позволяла объяснить устройство атома исходя из классических законов физики.
2. Сформулируйте первый постулат Бора.
3. Сформулируйте и запишите второй постулат Бора.
4.В чём заключаются противоречия между постулатами Бора и законами классической механики и классической электродинамики?
Как следует из постулатов, вопреки классической электродинамике электроны движутся по замкнутым орбитам и электромагнитные волны при этом не излучают.
5. При каком условии происходит излучение, а при каком условии происходит поглощение энергии атомом? При поглощении света, атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. При излучении атом переходит из стационарного состояния с большей энергией, в стационарное состояние с меньшей энергией.
6. Какого значение теории Бора в развитии физической науки?
Теория Бора явилась важным этапом в развитии квантовых представлений о строении атома. Бор определил радиус атома водорода и энергии стационарных состояний атома. Это позволило вычислить частоты излучаемых и поглощаемых атомом водорода электромагнитных волн. Теория Бора позволяет описать не только атом водорода, но и водородоподобные ионы других элементов.
Работа с учебником: найдите в учебнике на стр.278 изображение диаграммы энергетических уровней атома водорода. Вопросы:
6.На рисунке12.4,стр278 изображена диаграмма энергетических уровней атома водорода.Энергия ионизации атома равна: а)0; б)3.4эВ; в)0.54эВ; г)13.6эВ
Ответ: 13.6эВ. Энергия ионизации — энергия, которую нужно затратить для перевода электрона из основного состояния в состояние с нулевой энергией. Исходя из диаграммы, в основном состоянии электрон имеет энергию Е = -13.6эВ.
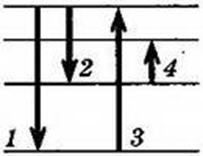
7.Сколько квантов (с различной энергией) может испускать атом водорода, если электрон находится на третьем возбужденном уровне. (Рис12.4,стр278)
Ответ: атом водорода может испускать кванты с тремя различными энергиями .Возможные переходы: n=3 —n=1,n=2— n=1, n=3— n=2.)
5. Закрепление новых знаний (10 мин). В зависимости от желания и способностей учащимся предлагаются следующие виды заданий.
1Уровень сложности задания: решить задачу у доски (возможна помощь учителя)
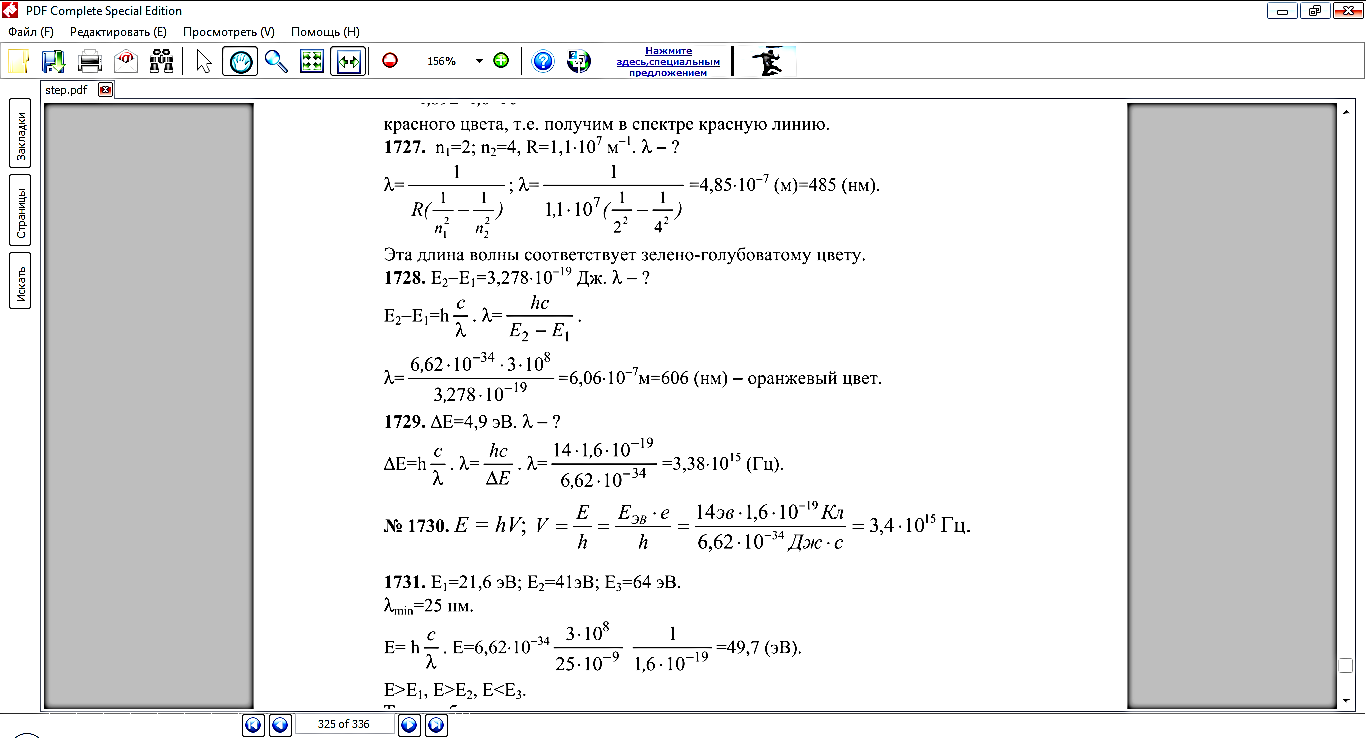
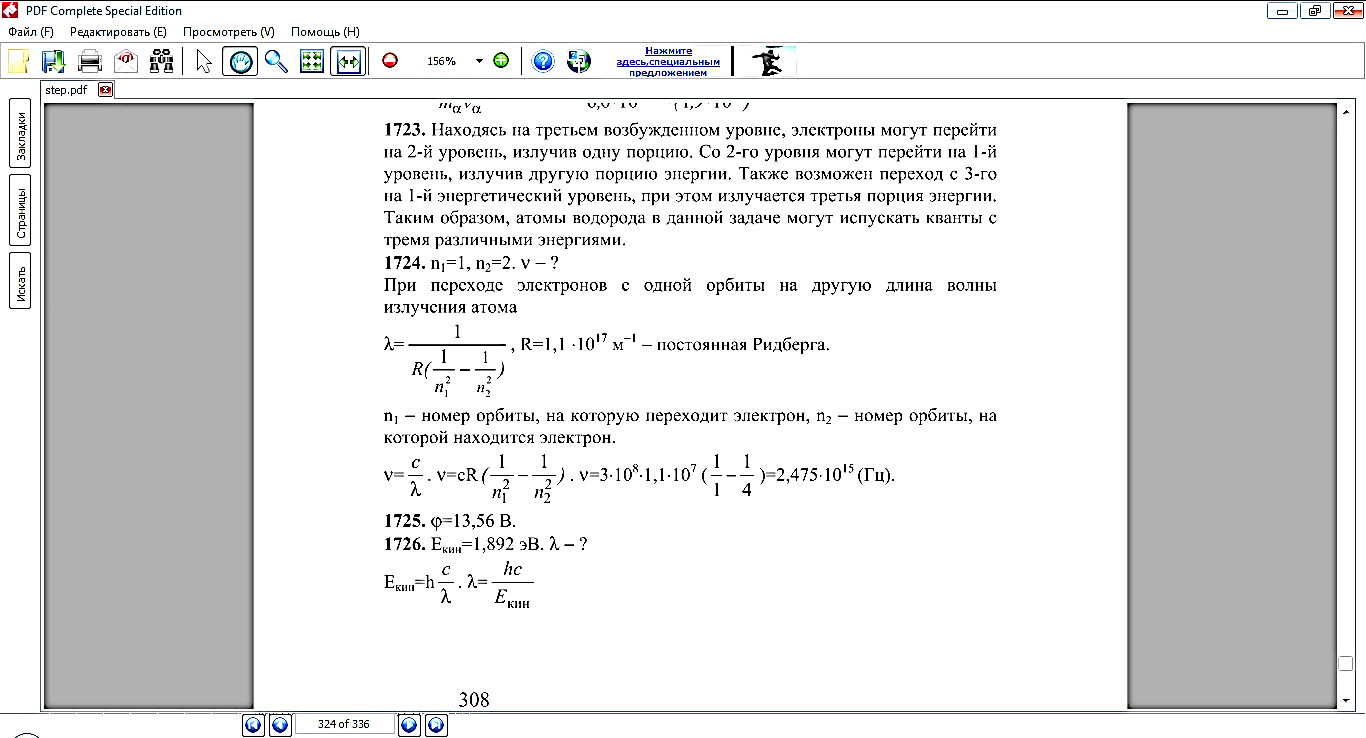
(Сборник задач по физике 10-11 класс Г.Н. Степанова №1724, №1728)
2 Уровень сложности задания: самостоятельно выполнить тест.
ТЕСТ № 2 (для учеников, сидящих за столами « на втором варианте»)
1.Электрон, связанный с атомом, при переходе с более удалённой орбиты на менее удалённую от атома орбиту в момент перехода……
(излучает энергию)
2.С ростом главного квантового числа n (энергитического уровня атома) энергия стационарного состояния атома……
(увеличивается)
3.Что с точки зрения планетарной модели Резерфорда удерживает электроны в атоме и не позволяет им разлететься?
(кулоновские силы)
4.Электрон в атоме водорода перешёл с первого энергетического уровня на третий. Как при этом изменилась энергия атом?
(увеличилась)
5. На рисунке представлена диаграмма энергетических уровней атома. Какой из переходов в спектре поглощения атома соответствует наименьшей частоте?
6. Длина волны для фотона, излучаемого атомом при переходе из возбужденного состояния с энергией Е1 в основное состояние с энергией E0, равна… (с — скорость света, h — постоянная Планка)
1. (E0—E1)/h
2. (E1—E0)/h
3. ch/(E1-E0)
4. ch/(E0-E1) (Ответ: 3)
7. Электрон внешней оболочки атома сначала переходит из стационарного состояния с энергией Е1 в стационарное состояние с энергией Е2, поглощая фотон частотой ν1. Затем он переходит из состояния Е2 в стационарное состояние с энергией E3, поглощая фотон частотой ν2 > ν1. Что происходит при переходе электрона из состояния E3 в состояние Е1?
1. излучение света частотой ν2 – ν1
2. поглощение света частотой ν2 – ν1
3. излучение света частотой ν2 + ν1
4. поглощение света частотой ν2 + ν1 (Ответ:3)
3.Уровень сложности задания: самостоятельно решить задачи
Упр.13(2), решение
Упр.13(1) , решение
6. Итоги урока (4мин):
1.Выставление оценок за работу на уроке.
2. ГРУППОВАЯ РЕФЛЕКСИЯ – по кругу высказываемся одним предложением, используя начало фразы из рефлексивного экрана:
|
7.Организиция домашнего задания(1мин) § 94,95.
Список использованной литературы
1.Мякишев Г. Я., Физика. 11 класс : учеб. для общеобразоват. учреждений : базовый и профил. уровни / Г. Я. Мякишев, Б. В. Буховцев, В. М. Чаругин; под ред. В. И. Николаева, Н. А. Парфентьевой. — 17-е изд., перераб. и доп. — М. : Просвещение, 2008. — 399 с : ил.
2.Волков В.А. Поурочные разработки по физике: 11 класс.- М : ВАКО.2006.- 464с.- ( В помощь школьному учителю).
ISBN 5-94665-348-2
3.Сборник задач по физике: Для 10-11 кл. общеобразоват. учреждений/ Сост. Г.Н. Степанова.-10-е изд.- М.: Просвещение, 2004.-288 с. : ил. – ISBN 5-09013438-3.
Использованные материалы и Интернет-ресурсы
1. Образовательный комплекс ФИЗИКА, 10–11 класс. ПОДГОТОВКА К ЕГЭ. ( Cистема программ «1С: Образование 3.0») . Раздел « Квантовая и ядерная физика» . CD. 2004г.
2. http://fiz.1september.ru
3.http://studyport.ru