«Методическая разработка »
Изучение темы « Растворение. Растворимость веществ в воде».
( 8 класс)
Автор: Ковалева Евгения Юрьевна,
учитель химии МКОУ «СОШ № 44»
Миасский городской округ
Пояснительная записка
Методическая разработка представляет собой описание подхода к изучению темы « Растворение. Растворимость веществ в воде». Разработка урока для 8 класса. Составлена в соответствии с программой О.С. Габриеляна. Учитель знакомит учащихся с основами физико – химической теории растворения. Урок предшествует изучению темы электролитической диссоциации, не всегда у учителя есть достаточное количество времени на изучение данной темы, на мой взгляд, материал изучаемого урока очень важный, на данном уроке формируется представление о растворимости веществ, типах растворов, кристаллогидратах, отрабатываются умения решать задачи с использованием графиков «Растворимость солей в зависимости от температуры», учащиеся знакомятся с расчетами, связанными с кристаллогидратами. В курсе химии основной школы большое значение имеют вопросы, связанные с поведением веществ в растворах, причем практически, всегда речь идет о водных растворах. Связано это с тем, что водные растворы играют важную роль в нашей жизни, с ними каждый из нас постоянно сталкивается как в быту, так и на производстве. Да и сам организм человека содержит растворы самых разных веществ. Материал урока предполагает использование дополнительного материала, связанного со знакомством с учёными, исследовавшими растворы и процесс растворения. Предлагаю для проведения данного урока готовую разработку учебного занятия, презентацию, рабочую карточку для учащегося и дополнительный материал о жизни ученых. Методика проведения данного занятия успешно апробирована мною в 8 классах, урок проходит интересно, в увлекательной форме.
Цель урока:
-
познакомить учащихся с растворением как физико — химическим процессом, показать зависимость растворимости твердых веществ от температуры· классифицировать растворы по принципу растворимости.
2. развивать мышление: умение наблюдать сравнивать, анализировать; делать выводы;
3. способствовать развитию коммуникативной культуры учащихся;
4. воспитывать познавательную активность учащихся
Оборудование:
1.Учебник «Химия», 8 класс, автор О.С. Габриелян, М.: Дрофа 2009;
2. Комплект ЦОР к учебнику «Химия», 8 класс, 12-е изд.- М.: Дрофа, 2006;
3. Мультимедийный проектор и экран; презентация.
4. Рабочая карточка учащегося
5.Реактивы: конц. серная кислота, вода,тв.щелочь натрия, нитрат аммония, кристаллогидрат сульфата меди, стаканчики, стеклянная палочка, фанерка, кристаллизатор с снегом ( его можно приготовить на перемене), термометр.
| Основные дидактические задачи | Формы организации деятельности учащихся |
Методы | Средства обучения | Пример-ное время | |
| 1 этап. Организацион-ный |
| фронтальная |
|
| 1 минута |
| 2 этап. Актуализация опорных знаний. |
| фронтальная | Ответы на вопросы, эвристичес-кая беседа | презентация | 2 минуты |
| 3 этап. Целеполагание |
| фронтальная | Беседа |
| 1 минута |
| 4 этап. Изучение нового материала. |
| фронтальная, групповая, индивидуальная | Лаборатор-ный эксперимент, эвристичес-кая беседа, выполнение заданий частично-поискового характера, решение задач | Оборудование и реактивы . | 24-25 минут |
| 5 этап. Закрепление, контроль и коррекция полученных знаний. |
| работа в парах | выполнение заданий | Карточки с условиями задач | 15 минут |
| 6 этап. Информа ция о домашнем задании. |
| фронтальная |
|
| 2 минуты |
Тип урока: усвоение новых знаний.
Методы обучения:
-
эвристический
-
проблемно-поисковый
-
экспериментальный
-
наглядный
-
самостоятельной работы
Формы организации познавательной деятельности:
-
фронтальная
-
индивидуальная
-
коллективная
Формы контроля:
-
беседа
-
самопроверка
Ход урока.
I. Орг. момент: Здравствуйте, ребята! Садитесь. Я рада вас видеть, и хочу, чтобы наш урок прошёл успешно. Успешным он будет, если всем нам будет интересно. Скажите, как вы считаете, какое вещество на Земле является главным: без него невозможна жизнь, без его участия невозможны многие химические реакции? (вода)
Почему вы так считаете? Каким уникальным свойством оно обладает? Правильно, это способность растворять различные вещества: и газы, и жидкости, и, конечно, твёрдые вещества. Поэтому сегодня мы поговорим о растворах. Запишем тему урока.
II.Актуализация знаний: Слайд № 2 . Растворы могут быть жидкие, твердые, газообразные (примеры), но не только водные: раствор йода в спирте. Ещё примеры?
Газовые растворы? Воздух. Твёрдые растворы? Сплавы. Слайд № 3. Но обычно, когда мы говорим «растворы», мы имеем в виду водные растворы.
III. Целеполагание: что же происходит при растворении с веществами?
Проделаем опыт: Возьмём небольшое количество соли, поместим в стаканчик, добавим воды, размешаем. Внимательно наблюдаем за тем, что происходит и попробуем сделать вывод, о том, какое явление наблюдаем. Растворение – это физический или химический процесс?
IV.Изучение нового материала: (в ходе беседы выясняют) наблюдали перемешивание, диффузию, т.е. растворение – физический процесс. Растворы – однородные смеси. Теория Вант — Гоффа, Оствальда, Аррениуса. Слайд № 4.(по ходу урока, учащиеся переносят схему к себе в тетрадь, составляют опорный конспект, по которому будут готовиться дома). Давайте попробуем приготовить еще один раствор – раствор серной кислоты. ( Помни: не лей воду в кислоту, а лей кислоту в воду).
Демонстрационный опыт учителя — смешивание воды и серной кислоты. Выделение тепла, т.е. растворение — химический процесс. Основоположники теории Менделеев, Каблуков. Кистяковский. Растворение – это процесс химического взаимодействия вещества с водой — гидратация. Растворы – это гидраты.
Так что же представляет собой растворение — химический или физический процесс? Современная теория растворов: и то, и другое. Слайд № 5.(Выводы записываем в тетрадь).
Растворение — это физико-химический процесс.
Растворы – это однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия — гидратов.
Ваша задача выявить признаки химического взаимодействия при растворении. Пронаблюдайте эксперимент и занесите его результаты в таблицу. Слайд № 6,7.
| Опыт | Наблюдения | Вывод | |
| 1. растворение в воде сульфата меди
| Видео (презентация) |
|
|
| 2. растворение в воде гидроксида натрия.
| Видео (презентация) |
|
|
| 3.растворение нитрата аммония | Демонстрация учителем |
|
|
Делаем выводы и записываем в тетрадь Слайд№7.Признаки химического взаимодействия. 1.Тепловые явления а) Экзотермическая реакция (растворение серной кислоты и гидроксида натрия).Демонстрационный эксперимент( учитель показывает опыт : примерзание фанерки к стаканчику при растворении нитрата аммония).
б) Эндотермическая реакция (растворение нитрата аммония и хлорида натрия)
2.Изменение цвета а) Растворение безводного сульфата меди, получение кристаллов медного купороса.
Далее рассматриваем факторы, от которых зависит растворимость твердых веществ. Слайд№8.
Какой чай вы предпочитаете пить, когда торопитесь: горячий, но сладкий, или теплый, но без сахара.
Выясните, от чего зависит растворимость твердых веществ?
— На какие группы можно разделить вещества по растворимости? (видео)
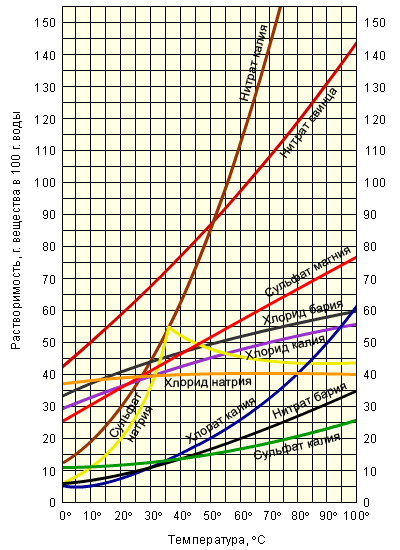
Работа с графиками растворимости различных солей. Слайд№9.
Проанализируйте графики растворимости некоторых солей в воде при различных температурах и ответьте на вопросы:
-
Чему равна растворимость
сульфата калия при температуре 75о?
2. Чему равна растворимость
хлората калия при температуре 10о?
Слайд№10.Типы растворов по содержанию растворенного вещества.
-
Ненасыщенные (вещество при данной температуре еще растворяется)
-
Насыщенные (вещество больше не растворяется)
-
Перенасыщенные (содержат в растворе больше вещества, чем насыщенный раствор).
Продолжение работы с графиками. ( Учащиеся работают с графиками на стр. учебника и отвечают на вопросы). Задания для учащихся напечатаны на карточках.
Вопрос 1: При растворении в воде хлорида калия массой 35 г при 40◦С получится раствор:
А) насыщенный; Б) ненасыщенный.
(выберите правильный ответ)
Вопрос 2: Раствор будет насыщенным при 20◦С, если растворить в воде ________ г нашатыря.
Вопрос 3: Из трех приведенных солей наилучшей растворимостью в воде в заданном интервале температур обладает ________________________, а хуже всего растворим(а) в воде ________________________.
Вопрос 4: Вставьте пропущенные слова:
С повышением температуры растворимость твердых веществ в воде, как правило, _____________________ .
V.Закрепление, контроль и коррекция полученных знаний.
-
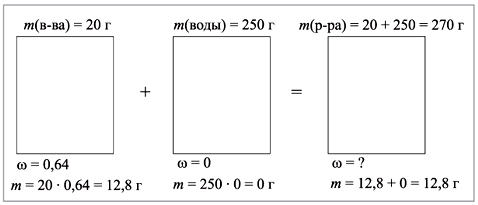
Решение задачи с использованием понятия кристаллогидраты.
20 г пентагидрата сульфата меди(II) растворили в 250 г воды. Какова массовая доля сульфата меди в полученном растворе?
-
Р е ш е н и е
CuSO4•5H2O – пентагидрат сульфата меди(II), или медный купорос. Найдем массовую долю соли в кристаллогидрате
М(CuSO4•5H2O) = 250 г/моль,
M(CuSO4) = 160 г/моль,
(напомним, что массовая доля – всегда отношение массы части к массе целого).
Ответ. Массовая доля сульфата меди
в полученном растворе равна 4,7%.
Если позволяет время или на втором уроке, предлагаю вспомнить расчетные задачи по теме «Растворы. Массовая доля вещества в растворе». Задания в карточке.
Решение задач.
-
Рассчитайте массовую долю серной кислоты в растворе, полученном смешением 20 г кислоты и 60 г воды.
-
При приготовлении компота сироп готовится из расчета 30 г сахара на 160 г воды. Чему равна массовая доля сахара в этом сиропе?
-
Какая масса этилового спирта требуется для приготовления 3%-ой йодной настойки из 5 г йода?
-
Какие массы хлорида натрия и воды нужно взять для приготовления 60 г раствора с массовой долей соли 3%?
Для более глубокого осмысления материала полезно обсудить с учащимися ответы на следующие вопросы:
-
Почему в жаркий день рыбам плохо дышится в водоеме?
-
Почему в горячем чае сахар растворяется быстрее, чем в холодном?
-
Растворимость какой соли практически не зависит от температуры?
VI. Домашние задание:
§34 (О.С.Габриелян 2009г.) стр. 192 ответить на вопросы.
Доп. задание .раб. тетрадь О.С.Габриеляна 123-124(1,2,6,8,9).
Подведение итогов урока. Выставление отметок.
Литература.
-
1september.ru.Решение задач на растворы.
-
school-collection.edu.ru Единая коллекция Цифровых Образовательных Ресурсов
-
http://nsportal.ru/shkola/khimiya/library/plan-konspekt
-
Воскобойникова Н.П. К вопросу о педагогических технологиях/ Н.П. Воскобойникова, И.В. Галыгина, Л.В. Галыгина// Химия в школе.– 2002. – № 2 – с. 16-21.
-
Учебник «Химия», 8 класс, автор О.С. Габриелян, М.: Дрофа 2009;
-
Настольная книга учителя О.С. Габриелян, М.: Дрофа 2003.
Карточка для учащегося.
| Опыт | Наблюдения | Вывод | |
| 1. растворение в воде сульфата меди | Видео (презентация) |
|
|
| 2. растворение в воде гидроксида натрия | Видео (презентация) |
|
|
| 3.растворение нитрата аммония | Демонстрация учителем |
|
|
Задание №2
Проанализируйте графики растворимости некоторых солей в воде при различных температурах и ответьте на вопросы:
Вопрос 1: При растворении в воде хлорида калия массой 35 г при 40◦ С получится раствор:
А) насыщенный; Б) ненасыщенный.
(выберите правильный ответ)
Вопрос 2: Раствор будет насыщенным при 20◦С, если растворить в воде ________ г нашатыря.
Вопрос 3: Из трех приведенных солей наилучшей растворимостью в воде в заданном интервале температур обладает ________________________, а хуже всего растворим(а) в воде ________________________.
Вопрос 4: Вставьте пропущенные слова:
С повышением температуры растворимость твердых веществ в воде, как правило, _____________________ .
Задание №3 Решение задач.
1. 20 г пентагидрата сульфата меди(II) растворили в 250 г воды. Какова массовая доля сульфата меди в полученном растворе?
2.Рассчитайте массовую долю серной кислоты в растворе, полученном смешением 20 г кислоты и 60 г воды.
3.При приготовлении компота сироп готовится из расчета 30 г сахара на 160 г воды. Чему равна массовая доля сахара в этом сиропе?
4.Какая масса этилового спирта требуется для приготовления 3%-ой йодной настойки из 5 г йода?
5.Какие массы хлорида натрия и воды нужно взять для приготовления 60 г раствора с массовой долей соли 3%?
Для более глубокого осмысления материала полезно обсудить с учащимися ответы на следующие вопросы:
-
Почему в жаркий день рыбам плохо дышится в водоеме?
-
Почему в горячем чае сахар растворяется быстрее, чем в холодном?
-
Растворимость, какой соли практически не зависит от температуры?