 ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ГИМНАЗИЯ №363 ФРУНЗЕНСКОГО РАЙОНА САНКТ-ПЕТЕРБУРГА
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ГИМНАЗИЯ №363 ФРУНЗЕНСКОГО РАЙОНА САНКТ-ПЕТЕРБУРГА
Методическое объединение учителей естественно-научного цикла
Химия
Разработка урока химии на тему «Коррозия» для 9 класса
Работа выполнена учителем химии ГБОУ гимназия №363
Самойловой Ириной Алекандровной
Санкт-Петербург
2014Методическая разработка урока
Цель урока
Дать понятия о коррозии металлов, познакомить учащихся со способами защиты металлов от коррозии.
Задачи
Познавательные. .
-
Закрепить представления об окислительно-восстановительных реакциях на примере коррозии
-
Научить использовать приобретённые знания для объяснения явлений окружающей среды и химически грамотного использования металлических изделий.
Развивающие
-
Продолжить формирование навыков работы в группе, развитие умений находить совместно правильное решение.
-
Развитие умения применять знания, полученные на различных предметах, для решения конкретных задач, умения наблюдать, анализировать и делать выводы из эксперимента.
Воспитательные.
-
Воспитание бережного отношения к культурному наследию города, ответственного отношения к исполнению профессиональных обязанностей.
-
Развитие коммуникативной культуры, культуры выступления перед коллективом.
Содержание учебного материала
Изучение нового материала
-
Понятие о коррозии как окислительно-восстановительном процессе
-
Причины коррозии
-
Виды коррозии
Анализ экспериментальных данных о влиянии различных факторов на скорость коррозии
-
Состава электролита
-
Контакта с другим металлом
-
Присутствия кислорода
Поиск способов защиты от коррозии на основе жизненного опыта и материалов урока
Мини-тест
Этапы урока с подробным описанием видов деятельности учителя и учащихся.
1.Вводное слово учителя. Постановка проблемы.
Всем известен афоризм: «Все течет, все изменяется.» Еще Аристотель утверждал, что движение – это жизнь. Но согласитесь, когда мы видим на улицах нашего города такие картинки, то кроме понятного любопытства, возникает вопрос: «А зачем эти многотонные памятники – символы нашего города тронулись в путь?»
Этот вопрос я адресую вам.
На данных фотографиях вы видите возвращение «Коней Клодта» и «Самсона» на их историческое место после реставрации. А чем вызвана была необходимость реставрации? Что явилось причиной разрушения великих памятников? Как происходит этот процесс? И ,главное, можно ли его предотвратить?
На все эти вопросы мы должны будем получить ответ к концу урока, тема которого «Коррозия металлов».
2. Изучение нового материала
Слово коррозия в переводе с латинского обозначает «разъедать». Хотя чаще всего этот термин относят к металлам, но применяют его и к камню, и к пластмассам и даже к дереву.
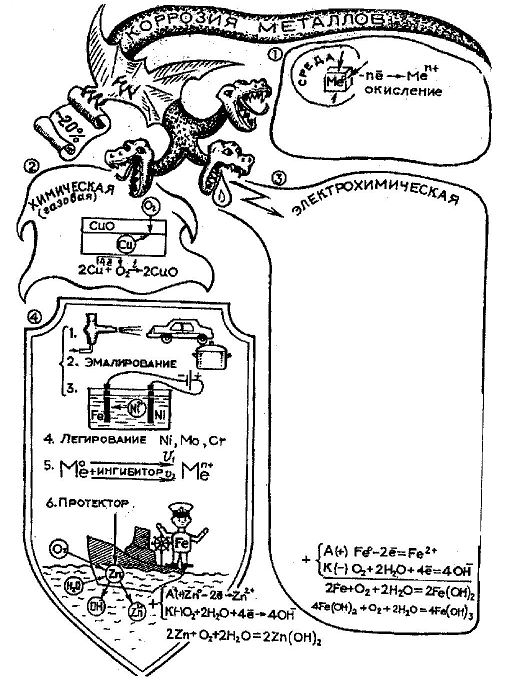
Т.о.коррозией называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды, при этом металлы окисляются по схеме Ме0 – ne → Меn+.
Эти процессы широко распространены в окружающем мире и по разным оценкам потери от коррозии составляют от 20 до 30% выплавляемого железа и его сплавов идет на то, чтобы возместить ущерб, нанесенный коррозией. В развитых странах стоимость потерь, связанных с коррозией составляет 3-4% валового национального дохода.
Обратимся к некоторым громким событиям связанным с процессами разрушения металла. Авария на АЭС в Японии, обвал моста в Америке и …Хроника новостей из Купчино. Все помнят горячие гейзеры на проезжей части на перекрестке у школы. Причиной тому явился износ теплотрассы, иначе говоря, коррозия металлических труб с кипятком.
Различают 2 вида коррозии – химическую и электрохимическую. Познакомимся с электрохимической (ЭХК). Она происходит в токопроводящей среде при контакте двух металлов и сопровождается возникновением электрического тока. Рассмотрим ЭХК в нейтральной среде.
На поверхности металлических изделий, находящихся в атмосферных условиях, всегда конденсируется влага. Она образует пленку, играющую роль электролита.(В опорном конспекте эта часть схемы представлена каплей. Учащиеся заполняют схему вместе с учителем, рисующим на доске) Если в среде электролита находится контактная пара, например, медь и железо, то возникает гальванический элемент. Ионы более активного металла (железа) переходят в раствор, при этом поверхность железа заряжается положительно (анод). Электроны с поверхности железа перетекают на поверхность более электроположительного металла (меди), в результате чего она заряжается отрицательно (катод). На поверхности меди происходит восстановление кислорода.
А+ Fe0— 2e → Fe2+ Fe2+ + 2OH— → Fe(OH)2
K— O2 +2H2O + 4e → 4OH—
Ионы двухвалентного железа, перешедшие в раствор, взаимодействуют с гидроксид-ионами, образуя нерастворимый гидроксид железа (II).
2Fe +O2 + 2H2O → 2Fe(OH)2
Окисляясь, гидроксид железа (II) превращается в гидроксид железа (III)
4 Fe(OH)2 + 2H2O + O2 → 4 Fe(OH)3
Проанализируем данный процесс коррозии и сделаем вывод о том, какой из двух металлов, находящихся в гальванической паре, будет подвергаться разрушению.
Вывод. В результате электрохимической коррозии разрушается более активный металл – металл стоящий раньше в электрохимическом ряду напряжений.
При химической коррозии электрический ток не возникает. Это возможно, если металл окисляется, например, сухими газами.
-
Работа в группах.
Предлагаю вам проанализировать результаты опытов по коррозии.
Группа 1.
Задание А. В стаканчике 1 железный гвоздь опущен в воду. В стаканчике 2 железный гвоздь опущен в раствор поваренной соли. В стаканчике 3 железный гвоздь опущен в раствор щелочи.
Сравните коррозию в растворе 2 и 3 с коррозией в воде. Сделайте вывод о том, какие ионы ускоряют процесс разрушения железа, а какие замедляют ( как называют вещества, изменяющие скорость реакции?)?
Задание Б. Зимой, когда тротуары посыпают солью, усиливается коррозия транспортных средств и подземных коммуникаций. Почему это происходит?
Группа 2.
Задание А. Во всех стаканчиках раствор хлорида натрия. В одном из них железная скрепка соединена с медной проволокой, в другом – с гранулой цинка. Объяснить результаты опыта.
Задание Б. Почему стоматологи не рекомендуют рядом со стальной коронкой ставить золотую?
Группа 3.
Задание А. Железный гвоздь опущен в стакан с водопроводной водой и дистиллированной кипяченой водой. Чем объяснима разная степень коррозии?
Задание Б. Известно, что железные изделия без дополнительных мер защиты и ухода ржавеют. Более полутора тысяч лет назад в Индии была изготовлена железная колонна, стоящая ныне на одной из площадей индийской столицы.
Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии. Почему на нее не действует коррозия?
-
Обсуждение результатов работы групп.
-
Поиск методов защиты от коррозии
Теперь, когда нам уже достаточно много известно о коррозии, обобщим наши знания : от чего зависит коррозия
-
от состава металла или сплава
-
от состава окружающей среды
-
от возможности контакта с окружающей средой
Это и определяет многообразие методов защиты – мы можем изменить состав сплава- ввести в него добавки, которые препятствуют коррозии, можем использовать металлическое изделие в менее агрессивной среде, а можем покрыть его краской, лаком и металлом, устойчивым к коррозии. Отдельно хочу остановиться на незнакомом для вас методе защиты от коррозии – электрохимическом. Принцип его работы основан на том, что при существовании пары металлов разрушается тот металл, который выполняет роль анода. Пока он до конца не разрушится, второму металлу коррозия не страшна.
-
Повторение по опорному конспекту
В заключении вспомним с помощью опорного конспекта наиболее важные аспекты урока
-
Итоговый тест. И проверим, насколько внимательными вы были. Тест содержит только 5 вопросов, в задании с выбором ответа правильным является только один.
-
Домашнее задание стр 170-173, в 7 стр 174 (п) Найти ответ на следующие вопросы:
Перед вами два непохожих друг на друга «Медных всадника». ( один «зеленый» — в патине», второй после реставрации – «серый».)Чем вызвано это различие? Какие внешние факторы (вещества) способствовали изменению цвета памятника? Прав ли А.С.Пушкин, назвав всадника «медным»?
Дидактические материалы и средства обучения
Раздаточный материал на карточках
-
Задание для эксперимента
| Группа 2. Задание А. Во всех стаканчиках раствор хлорида натрия. В одном из них железная скрепка соединена с медной проволокой, в другом – с гранулой цинка. Объяснить результаты опыта. Задание Б. Почему стоматологи не рекомендуют рядом со стальной коронкой ставить золотую? |
| Группа 3. Задание А. Железный гвоздь опущен в стакан с водопроводной водой и дистиллированной кипяченой водой . Чем объяснима разная степень коррозии? Задание Б. Известно, что железные изделия без дополнительных мер защиты и ухода ржавеют. Более полутора тысяч лет назад в Индии была изготовлена железная колонна, стоящая ныне на одной из площадей индийской столицы. Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии. Почему на нее не действует коррозия? |
-
Опорный конспект [4]
-
Бланк итогового теста
-
Лабораторный поднос с опытами по коррозии
Примеры выполнения заданий учащимися.[3]
Вариант 1
Дополните
-
Название процесса самопроизвольного разрушения металлов и сплавов под влиянием окружающей среды….
Установите правильную последовательность
-
Электрохимическая коррозия – это
-
возникновением
-
металла
-
тока
-
разрушение
5. электрического
6.сопровождаемое
Выпишите № правильного ответа
-
Луженое железо (покрытое защитной оловянной пленкой) поцарапали. После этого
-
ничего не произойдет
-
будет корродировать олово
-
будет корродировать и железо и олово
-
будет разрушаться железо
-
Какой из процессов не является коррозийным
-
-
Cu0 – 2e → Cu2+
-
Ni2+ + 2e → Ni0
-
Fe2+ – 1e → Fe3+
-
Ag0 – 1e → Ag1+
-
Какой из металлов наиболее подвержен химической коррозии
-
-
свинец
-
кальций
-
алюминий
-
железо
Вариант 2.
Установите правильную последовательность
-
Коррозия –
-
-
под влиянием
-
разрушение
-
среды
-
самопроизвольно
-
металлов
-
окружающей
-
и сплавов
Дополните
-
Металл, подвергающийся при контакте алюминия и меди — …
Выпишите № правильного ответа
-
Скорость коррозии возрастает при
-
добавлении ингибитора
-
контакте с более активным металлом
-
контакте с менее активным металлом
-
введении легирующих добавок
-
4. При коррозии металла происходит
1. восстановление металла
2. окисление металла
3. иногда окисление, иногда восстановление металла
4. не окислительно- восстанвительный процесс
5. Какой из перечисленных металлов наиболее легко подвергается химической коррозии
1. никель 2. хром 3. железо 4. Олово
При разработке урока использованы :
-
О.С. Габриелян учебник «Химия» 9 класс, Дрофа, М., 2012
-
О. С. Габриелян, И. Г. Остроумов «Химический эксперимент в школе. 9 класс», Дрофа, М., 2007
-
О.С.Габриелян, Н.П.Воскобойникова «Химия в тестах, задачах, упражнений, 8-9 классы», Дрофа, М., 2007
-
Т.В. Смирнова, И.И. Супоницкая. Опорный конспект в обобщении знаний о коррозии и защите металлов // Химия в школе. – 1997. — № 7 – с.40-42
-
http://festival.1september.ru/articles/417139/
-
Тема: «Тайна яхты «Зов моря»»
Зайцева О.В. Разработка урока «Тайна яхты «Зов моря»
-
http://www.uchportal.ru/load/60-1-0-10708
Иванова И.В. Презентация по теме «Коррозия»
-
http://www.openclass.ru/dig-resource/101362
Рябова Ольга Сергеевна Разработка урока «Коррозия»
-
http ://img -fotki .yandex .ru /get /4607/galinaapple .4f /0_159b 07_5ed 87874_XL
-
http://lenta.ru/world/2004/08/10/japan
-
http ://www .wowktv .com /story .cfm ?func =viewstory &storyid =71990&catid =88&printview =1
-
http://ru.wikipedia.org/